问题
-
25℃时电池反应H2(g)+1/2O2(g)=H2O(l)对应的电池标准电动势为E1,则反应2H2O(l)=2H2(g)+O2(g)所
-
已知反应N2+3H2= 2NH3 的标准平衡常数为K1ө, 反应 1/2 N2 (g) +3/2H2 (g) = NH3 (g)的 标准
-
工业上用乙苯脱氢制苯乙烯C6H5C2H5(g)===C6H5C2H3(g)+H2(g),如反应在900K下进行,其KΘ=1.51。试分别计算在下
-
醋酸可的松滴眼液处方是醋酸可的松5.0g,吐温800.8g,硝酸苯汞0.02g,硼酸20.0g,羧甲基纤维素钠2.0g
-
导致眼球震颤毒性反应的苯妥英钠的血浆浓度为 A.1 ~2μg/ml B. 5 ~10μg/ml C. 10 ~20μg/
-
导致心肌梗死毒性反应的丙戊酸钠的血浆浓度为 A.1 ~2μg/ml B. 5 ~10μg/ml C. 10 ~20μg/

 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。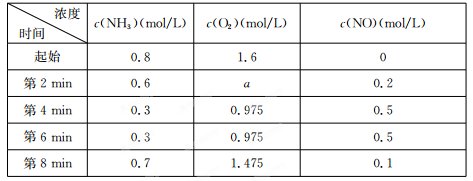
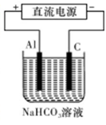
 4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。
4NO(g)+6 H2 O(g)达到平衡状态的是 (填序号)。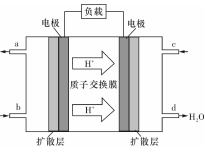
 冀公网安备 13070302000102号
冀公网安备 13070302000102号