问题
-
以K2Cr2O7标准溶液滴定Fe2+,计算25℃时反应的平衡常数;若化学计量点时Fe3+的浓度为0.05000mol·L-1,要使反应
-
将一块纯铜片置于0.050mol·L-1AgNO3溶液中。计算溶液达到XF衡后的组成。 (提示:首先计算出反应平衡常数。)
-
已知某反应在700K时,速率常数为:k=1.2dm3·mol-1·s-1,此反应的活化能为150kJ·mol-1,试计算800K时的反应速率
-
可逆反应2NO?N?O?+Q 50℃时平衡常数K1 0℃时平衡常数K2 100℃时平衡常数K3 则K1 K2 K3之间的数量关系是____。
-
在一定温度下 反应 的平衡常数 =4.0 今以A(l)和B(l)各1mol参与反应 平衡时的最大产率是( )A.0
-
对于一个可逆反应在一定的温度下达到平衡时 其正 逆反应平衡常数之间的关系是()。

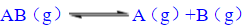 的平衡常数Kc=0.21mol·dm-3,则标准平衡常数
的平衡常数Kc=0.21mol·dm-3,则标准平衡常数 的值为______。
的值为______。 冀公网安备 13070302000102号
冀公网安备 13070302000102号