问题
-
反应:Zn+2H+(xmol·dm-3)=Zn2+(1mol·dm-3)+H2(100kpa)构成的原电池的电动势为0.46V,φθ(Zn2+/Zn)
-
某反应A+B+=A++B的平衡常数是104 则该电池的标准电动势Eθ是()V。A.2.40B.0.
-
铜锌原电池的标准电动势为1.11V 现有一铜锌原电池的电动势E=1.17V 则该电池中Cu2+与Z
-
若电池反应所对应的电池电动势为负值 表示此电池反应是A. 正向进行B. 逆向进行C. 不能进行D
-
原电池Zn+2Ag+=Zn2++2Ag在标准状态下的电动势为()。A.EΘ=2φΘ(Ag+/Ag)
-
因为国际上规定标准氢电极的电极电位为0 所以任何电极与它组成电池时 标准氢电极都为负极。()

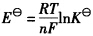 ,所以EΘ表示电池反应达到平衡时电池的电动势,对吗?
,所以EΘ表示电池反应达到平衡时电池的电动势,对吗? 冀公网安备 13070302000102号
冀公网安备 13070302000102号